Reakcja SN2 to kluczowy mechanizm w chemii organicznej, który odnosi się do substytucji nukleofilowej dwucząsteczkowej. W tej reakcji, nukleofil atakuje atom węgla z przeciwnej strony do grupy odchodzącej, co prowadzi do powstania stanu przejściowego i ostatecznego produktu. Mechanizm ten jest skoordynowany, co oznacza, że tworzenie nowego wiązania i zerwanie starego zachodzą równolegle, co czyni go wyjątkowym w porównaniu do innych mechanizmów reakcji chemicznych.
W artykule przyjrzymy się kluczowym cechom mechanizmu SN2 oraz czynnikom, które wpływają na jego szybkość. Zrozumienie tych aspektów jest istotne nie tylko dla studentów chemii, ale także dla profesjonalistów pracujących w dziedzinie syntezy organicznej. Odkryjemy, jak struktura substratów, właściwości nukleofili oraz wybór rozpuszczalnika mogą wpłynąć na przebieg reakcji SN2.
Kluczowe informacje:
- Mechanizm SN2 zachodzi w jednym etapie, prowadząc do powstania stanu przejściowego.
- Reakcja jest drugiego rzędu, co oznacza, że jej szybkość zależy od stężenia zarówno substratu, jak i nukleofila.
- Preferowane są substraty o niskim stopniu zatłoczenia sterycznego, takie jak halogenki metylowe i pierwszorzędowe.
- W przypadku asymetrycznego atomu węgla, zazwyczaj dochodzi do inwersji konfiguracji.
- Silniejsze nukleofile i polarnie aprotyczne rozpuszczalniki sprzyjają reakcji SN2.
- W przeciwieństwie do mechanizmu SN1, w SN2 nie powstaje pośredni karbokation, co eliminuje ryzyko racemizacji.
Zrozumienie mechanizmu SN2: Kluczowe cechy reakcji
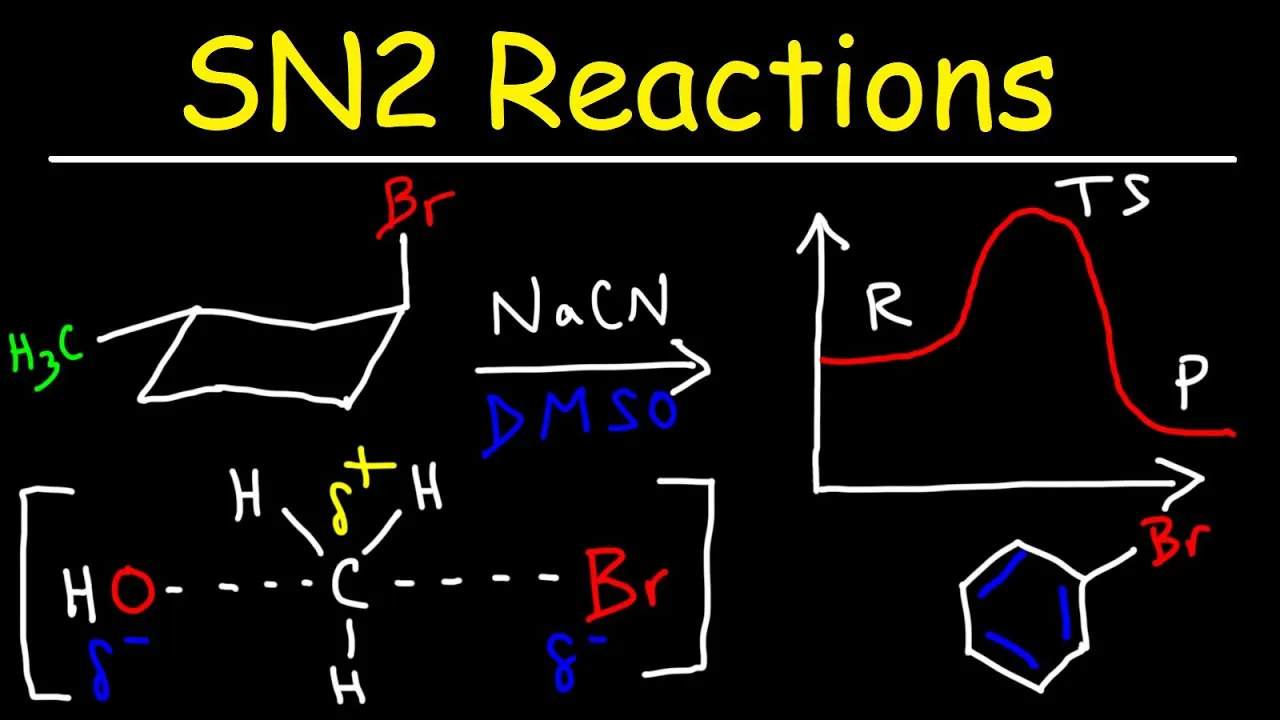
Mechanizm SN2, czyli substytucja nukleofilowa dwucząsteczkowa, to fundamentalny proces w chemii organicznej, który odgrywa kluczową rolę w wielu reakcjach chemicznych. W tej reakcji, nukleofil atakuje atom węgla z przeciwnej strony niż grupa odchodząca, co prowadzi do powstania stanu przejściowego. Mechanizm ten jest szczególnie interesujący, ponieważ zachodzi w jednym etapie, a jego przebieg jest skoordynowany, co oznacza, że tworzenie nowego wiązania oraz zerwanie starego zachodzą równolegle. Dzięki temu, mechanizm SN2 ma unikalne cechy, które różnią go od innych reakcji.
Warto zauważyć, że mechanizm SN2 jest drugiego rzędu, co oznacza, że szybkość reakcji zależy od stężenia zarówno substratu, jak i nukleofila. W przypadku reakcji na asymetrycznym atomie węgla, często dochodzi do inwersji konfiguracji, co jest znane jako inwersja Waldena. Mechanizm SN2 jest szczególnie sprzyjany w przypadku substratów o niskim stopniu zatłoczenia sterycznego, co czyni go kluczowym elementem w syntezie organicznej. W kolejnych częściach artykułu przyjrzymy się szczegółom tego mechanizmu oraz czynnikom, które wpływają na jego przebieg.
Czym jest mechanizm SN2 i jak działa w chemii organicznej?
Mechanizm SN2 jest definiowany jako proces, w którym nukleofil atakuje atom węgla, prowadząc do wymiany grupy odchodzącej. W tym mechanizmie, atom węgla staje się chwilowo pięciowiązalny, tworząc stan przejściowy o geometrii dwupiramidowej trygonalnej. Taki stan jest wysoce niestabilny i szybko przekształca się w produkt końcowy. Kluczowym aspektem mechanizmu SN2 jest to, że nie powstaje pośredni karbokation, co eliminuje ryzyko racemizacji w przypadku substratów chiralnych.
W praktyce, mechanizm ten jest wykorzystywany w wielu reakcjach chemicznych, w których istotne jest zachowanie stereochemii. Warto podkreślić, że mechanizm SN2 ma swoje ograniczenia, takie jak niska szybkość reakcji w przypadku substratów trzeciorzędowych, gdzie występują silne przeszkody steryczne. Zrozumienie mechanizmu SN2 jest kluczowe dla chemików, którzy chcą efektywnie projektować i przeprowadzać reakcje chemiczne w laboratoriach.
Kluczowe etapy reakcji SN2: Od stanu przejściowego do produktu
Reakcja SN2 przebiega w kilku kluczowych etapach, które są niezbędne do zrozumienia mechanizmu SN2. Proces ten rozpoczyna się od ataku nukleofila na atom węgla, który jest związany z grupą odchodzącą. W tym momencie, nukleofil zbliża się do atomu węgla z przeciwnej strony niż grupa odchodząca, co prowadzi do powstania stanu przejściowego. Ten stan jest charakterystyczny, ponieważ atom węgla staje się chwilowo pięciowiązalny, a geometria stanu przejściowego przyjmuje formę dwupiramidową trygonalną.
Następnie, w wyniku dalszego postępu reakcji, grupa odchodząca zostaje uwolniona, a nowe wiązanie między nukleofilem a atomem węgla zostaje utworzone. To przekształcenie jest bardzo szybkie, ponieważ stan przejściowy jest wysoce niestabilny i szybko przekształca się w produkt końcowy. Ostatecznie, reakcja SN2 prowadzi do powstania nowego związku, w którym konfiguracja atomu węgla może ulec inwersji, co jest istotne w kontekście stereochemii.
| Etap | Opis |
|---|---|
| Atak nukleofila | Nukleofil zbliża się do atomu węgla, atakując go z przeciwnej strony niż grupa odchodząca. |
| Stan przejściowy | Atom węgla staje się pięciowiązalny, tworząc stan przejściowy o geometrii dwupiramidowej trygonalnej. |
| Uwolnienie grupy odchodzącej | Grupa odchodząca zostaje uwolniona, a nowe wiązanie między nukleofilem a atomem węgla jest utworzone. |
| Produkt końcowy | Powstaje nowy związek, w którym może nastąpić inwersja konfiguracji atomu węgla. |
Czynniki wpływające na szybkość reakcji SN2 i ich znaczenie
Reakcja SN2 jest złożonym procesem, którego szybkość jest uzależniona od różnych czynników. Kluczowe elementy wpływające na tempo tej reakcji to struktura substratów, siła nukleofili oraz wybór rozpuszczalnika. Każdy z tych czynników odgrywa istotną rolę w przebiegu reakcji, determinując, jak efektywnie przebiega wymiana grupy odchodzącej na nową grupę. W kolejnych akapitach omówimy każdy z tych aspektów, aby lepiej zrozumieć mechanizm SN2.
Struktura substratów ma ogromny wpływ na szybkość reakcji SN2. Substraty pierwszorzędowe, takie jak halogenki metylowe, sprzyjają tej reakcji, ponieważ mają niskie zatłoczenie steryczne, co umożliwia nukleofilowi łatwy dostęp do atomu węgla. Z kolei substraty trzeciorzędowe, takie jak halogenki trzeciorzędowe, wykazują znacznie wolniejsze tempo reakcji SN2, ponieważ silne przeszkody steryczne utrudniają atak nukleofila. W związku z tym, struktura substratów jest kluczowym czynnikiem, który należy brać pod uwagę podczas planowania reakcji chemicznych.
Rola substratów: Jak struktura wpływa na mechanizm SN2?
Struktura substratów ma fundamentalne znaczenie dla mechanizmu SN2. Substraty pierwszorzędowe pozwalają na swobodny atak nukleofila, co przyspiesza reakcję. W przypadku substratów drugorzędowych, tempo reakcji jest umiarkowane, a w przypadku substratów trzeciorzędowych, reakcja jest znacznie spowolniona z powodu silnych przeszkód sterycznych. Ostatecznie, wybór odpowiedniego substratu może znacząco wpłynąć na efektywność reakcji, co jest istotne dla chemików pracujących w laboratoriach.
Wpływ nukleofili i ich właściwości na reakcję SN2
Nukleofile odgrywają kluczową rolę w mechanizmie SN2, ponieważ ich właściwości bezpośrednio wpływają na szybkość reakcji. Silniejsze nukleofile, takie jak jony hydroksylowe (OH-) czy jony bromkowe (Br-), są bardziej skuteczne w atakowaniu atomu węgla, co przyspiesza proces substytucji. Z kolei słabsze nukleofile, takie jak woda (H2O), mogą nie być w stanie przeprowadzić reakcji SN2 w rozsądnym czasie, co znacznie obniża efektywność tego mechanizmu. Właściwości nukleofili, takie jak ich ładunek, rozmiar oraz polarność, mają zatem znaczący wpływ na przebieg reakcji SN2.
Zastosowanie rozpuszczalników: Jak wybrać odpowiedni?
Wybór odpowiedniego rozpuszczalnika jest kluczowy dla efektywności reakcji SN2. Rozpuszczalniki polarnie aprotyczne, takie jak acetonitryl czy dimetyloformamid, sprzyjają reakcji, ponieważ nie tworzą silnych interakcji z nukleofilami, pozwalając im na swobodny atak na substrat. W przeciwieństwie do rozpuszczalników polarnych proticznych, które mogą stabilizować nukleofile, rozpuszczalniki aprotyczne zwiększają szybkość reakcji, co czyni je preferowanym wyborem w reakcjach SN2. Odpowiedni wybór rozpuszczalnika może zatem znacząco wpłynąć na tempo i wydajność reakcji chemicznych.
Czytaj więcej: Jak mechanizm Goldberga może zrewolucjonizować twoje wydarzenia team buildingowe
Porównanie mechanizmów SN2 i SN1: Kluczowe różnice i podobieństwa
Mechanizmy SN2 i SN1 są dwoma fundamentalnymi typami reakcji substytucji nukleofilowej, które różnią się w sposób znaczący. Główna różnica polega na tym, że SN2 jest reakcją jednocząsteczkową, w której nukleofil atakuje substrat w jednym etapie, prowadząc do natychmiastowego powstania produktu. Natomiast SN1 jest reakcją dwucząsteczkową, która składa się z dwóch etapów: najpierw powstaje karbokation, a następnie nukleofil atakuje ten karbokation, co prowadzi do powstania produktu. W związku z tym, mechanizm SN1 jest bardziej podatny na stabilizację karbokationu, co czyni go korzystnym w przypadku bardziej złożonych substratów.
Dlaczego mechanizm SN2 jest preferowany w niektórych reakcjach?
Mechanizm SN2 jest preferowany w sytuacjach, gdy substraty mają niskie zatłoczenie steryczne, co umożliwia nukleofilom swobodny atak na atom węgla. Reakcje te są bardziej efektywne w obecności silnych nukleofili oraz w rozpuszczalnikach polarnych aprotycznych, które nie stabilizują nukleofila. Dodatkowo, mechanizm SN2 jest korzystny w przypadkach, gdy wymagane jest zachowanie stereochemii, ponieważ prowadzi do inwersji konfiguracji, co jest istotne w syntezie związków chiralnych. Wreszcie, mechanizm SN2 jest szybki i skuteczny, co czyni go preferowanym wyborem w wielu laboratoryjnych reakcjach chemicznych.
Inwersja konfiguracji w SN2: Co musisz wiedzieć?
Inwersja konfiguracji jest kluczowym aspektem mechanizmu SN2, który polega na zmianie stereochemii atomu węgla, na którym zachodzi reakcja. Gdy nukleofil atakuje atom węgla z przeciwnej strony do grupy odchodzącej, następuje inwersja konfiguracji, co oznacza, że nowy produkt ma przeciwną konfigurację do oryginalnego substratu. Ta cecha jest szczególnie istotna w syntezie związków chiralnych, gdzie zachowanie lub zmiana stereochemii może wpływać na właściwości biologiczne i chemiczne produktów. Inwersja konfiguracji jest zatem kluczowym czynnikiem, który należy brać pod uwagę podczas projektowania reakcji chemicznych w laboratoriach.
Praktyczne zastosowania mechanizmu SN2 w chemii organicznej
Mechanizm SN2 znajduje szerokie zastosowanie w chemii organicznej, szczególnie w syntezie związków chemicznych. Przykładem może być reakcja halogenków alkilowych z silnymi nukleofilami, takimi jak jony hydroksylowe (OH-) czy jony cyjanowe (CN-). W takich reakcjach, halogenki metylowe i pierwszorzędowe są często używane jako substraty, co prowadzi do powstania alkoholi lub innych związków organicznych. Mechanizm SN2 jest preferowany w tych reakcjach, ponieważ pozwala na szybkie i efektywne wytwarzanie produktów o pożądanej stereochemii.
Kolejnym przykładem zastosowania mechanizmu SN2 jest synteza estrów z użyciem kwasów karboksylowych i halogenków alkilowych. W takich reakcjach, nukleofil (kwas karboksylowy) atakuje atom węgla w substracie, co prowadzi do powstania estrowego produktu. Mechanizm SN2 jest szczególnie korzystny w tych przypadkach, ponieważ pozwala na kontrolowanie stereochemii końcowego produktu. Ostatecznie, mechanizm SN2 jest niezbędnym narzędziem w chemii organicznej, umożliwiającym tworzenie złożonych związków chemicznych z zachowaniem pożądanych właściwości.
- Reakcja halogenku metylowego z joniem hydroksylowym, prowadząca do powstania metanolu.
- Reakcja bromku etylu z joniem cyjanowym, prowadząca do powstania etanolu cyjanowego.
- Reakcja chlorku propylu z kwasem octowym, prowadząca do powstania octanu propylu.
Nowe kierunki w zastosowaniach mechanizmu SN2 w chemii organicznej
W miarę jak technologia chemiczna się rozwija, mechanizm SN2 zyskuje nowe zastosowania w syntezie związków farmaceutycznych oraz materiałów funkcjonalnych. Przykładem może być wykorzystanie reakcji SN2 w tworzeniu związków bioaktywnych, które mają zastosowanie w terapii nowotworowej. Dzięki precyzyjnemu kontrolowaniu stereochemii produktów, chemicy mogą projektować leki, które są bardziej skuteczne i mają mniejsze skutki uboczne. Dalsze badania nad reakcjami SN2 mogą prowadzić do odkrycia nowych szlaków syntezy, które umożliwią produkcję złożonych związków organicznych w sposób bardziej zrównoważony i efektywny.
Co więcej, rozwój technologii chemii komputerowej oraz symulacji molekularnych otwiera nowe możliwości w badaniach nad mechanizmem SN2. Dzięki tym technikom, naukowcy mogą lepiej przewidywać wyniki reakcji, co pozwala na optymalizację warunków reakcyjnych i selekcję odpowiednich substratów oraz nukleofili. Tego rodzaju podejście może zrewolucjonizować sposób, w jaki przeprowadzane są reakcje chemiczne, prowadząc do innowacyjnych rozwiązań w przemyśle chemicznym i farmaceutycznym.

